
SYNDROM POSZPITALNY – holistyczne spojrzenie na pacjenta po wypisie ze szpitala
dr hab. n. med. Dorota Mańkowska-Wierzbicka
Katedra i Klinika Gastroenterologii, Dietetyki i Chorób Wewnętrznych, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Prezes Polskiego Towarzystwa Żywienia Pozajelitowego, Dojelitowego i Metabolizmu, POLSPEN

Czym jest syndrom poszpitalny i kogo może dotyczyć?
Syndrom poszpitalny to okres osłabienia rozpoczynający się po przyjęciu do szpitala i trwający długo po zakończeniu hospitalizacji (2; 3). Jest to niezależny czynnik ryzyka ponownej hospitalizacji i powikłań (4) . Szacuje się, że nawet co 5 pacjent wymaga kolejnej hospitalizacji w ciągu 30 dni od wypisu, przy czym zaledwie 10-35% rehospitalizacji wynika z początkowej diagnozy. Oznacza to, że nawet w 90% przypadków pacjenci wracają do szpitala z przyczyn zupełnie innych niż choroba pierwotna. Etap zwiększonego ryzyka ponownej hospitalizacji stabilizuje się w okresie 7 tygodni po wypisie (4) .
Podłożem znacznego osłabienia po hospitalizacji jest zarówno choroba podstawowa wraz ze stanem zapalnym, jak i:
- nieadekwatna podaż białka i energii,
- nieadekwatna długość i struktura snu w trakcie hospitalizacji,
- nasilony niepokój (aktywacja układu współczulnego, osi HPA)
- oraz unieruchomienie (bedrest – bierność ruchowa) (ryc. 1).
Wszystkie te czynniki prowadzą do nasilenia szeregu zmian, w tym w układzie sercowo-naczyniowym, immunologicznym a także do nasilenia katabolizmu w konsekwencji prowadząc do częstszych zdarzeń niepożądanych i rehospitalizacji w przypadku pacjentów wypisanych ze szpitala.
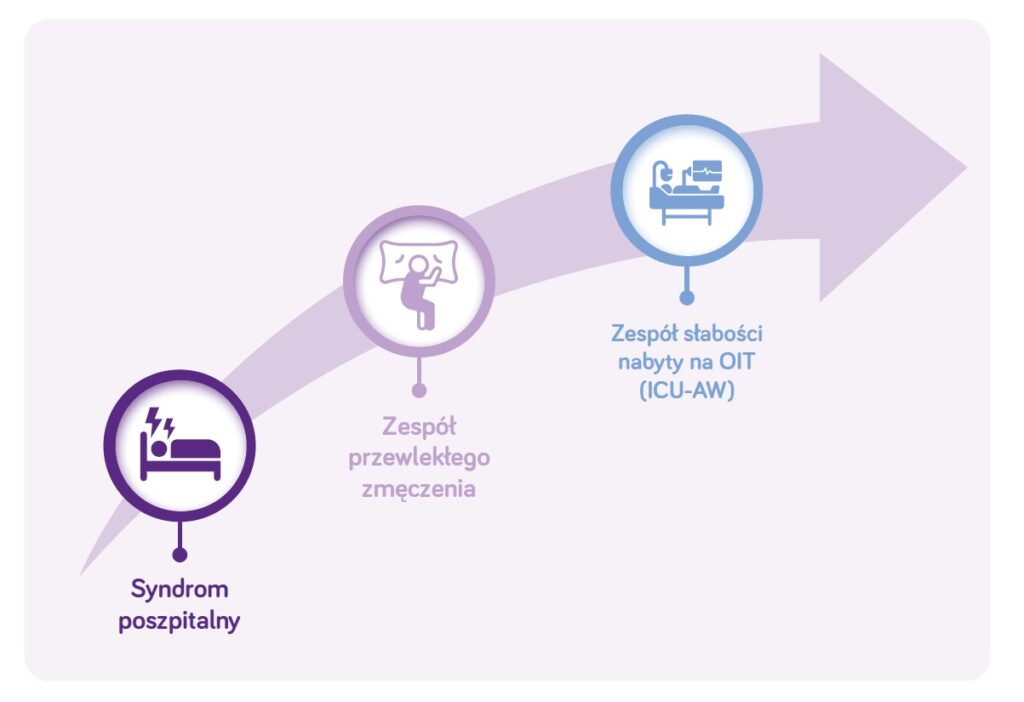
Osłabienie po hospitalizacji jest zjawiskiem od dawna znanym, zwłaszcza w obszarach terapeutycznych związanych z urazami zwłaszcza w chirurgii czy intensywnej terapii (ICU-acquired weakness) a także w obszarach związanych z leczeniem chorób przebiegających z ogólnoustrojowym stanem zapalnym np. w onkologii (zespół przewlekłego zmęczenia) (1) . Taki pacjent po wypisie ze szpitala znajduje się przede wszystkim pod opieką lekarza pierwszego kontaktu, stąd szczególna rola lekarzy medycyny rodzinnej w monitorowaniu przebiegu procesu rekonwalescencji oraz podjęcia adekwatnych działań w celu obniżenia ryzyka wystąpienia syndromu poszpitalnego.
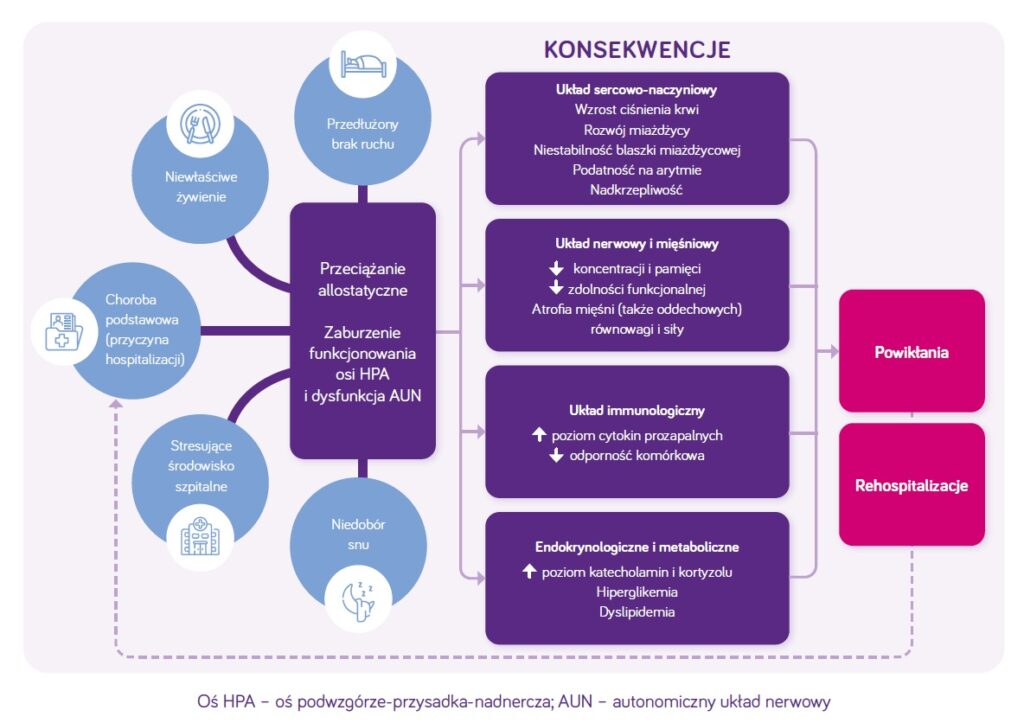
Fizjologiczna odpowiedź organizmu na chorobę podstawową, uraz
Katabolizm białek mięśni jest fizjologicznym procesem pojawiającym się w odpowiedzi na uraz lub chorobę, na wzrost cytokin prozapalnych. Jego nasilenie skorelowane jest z rozległością urazu i ciężkością choroby i w skrajnych sytuacjach (rozległe operacje, stan krytyczny) utrata tkanki mięśniowej może sięgać nawet 1 kg dziennie (5).
Dodatkowo warto zwrócić uwagę, że tkanka mięśniowa należy do tkanek podlegających szybkiemu obrotowi, czyli nieustannemu rozkładowi i ponownej syntezie (1-2%/dobę) a zachowanie masy mięśniowej jest procesem aktywnym, wymagającym zarówno ruchu, jak i odpowiednio wysokiej podaży białka.
Brak tych dwóch najsilniejszych sygnałów anabolicznych będzie związany z utratą masy mięśniowej. Oznacza to, że podczas choroby tkanka mięśniowa ulega rozpadowi zarówno w związku z fizjologiczną odpowiedzią na samą chorobę lub uraz, ale także ze względu na jej dynamiczną naturę.
W tym świetle staje się zrozumiałe, że nawet krótkotrwały pobyt w szpitalu w istotny sposób będzie przyczyniał się do rozwoju osłabienia po hospitalizacji u znacznej grupy pacjentów.
Syndrom poszpitalny – występowanie i przyczyny
Długotrwały spadek sprawności po wypisie obserwowany jest m.in. u:
1.ponad 30% pacjentów po rozległych zabiegach chirurgicznych (6)
2. ponad 50% pacjentów po przebytym zapaleniu płuc (7)
3. nawet 74% pacjentów po hospitalizacji na oddziale intensywnej terapii (8)
4. około 50% pacjentów starszych (2; 9).
Ogółem długotrwały spadek sprawności po wypisie ogółem dotyczy co 5 pacjenta wypisywanego ze szpitala (4).
Na syndrom poszpitalny szczególnie narażeni są pacjenci powyżej 65. roku życia, a zwłaszcza pacjenci w wieku podeszłym, powyżej 80. roku życia (10).
Przyczyną osłabienia zarówno w przypadku krótkotrwałych hospitalizacji, jak i w przypadku rozległych urazów są te same mechanizmy:
- katabolizm tkanki mięśniowej (utrata masy),
- zmiany w jej morfologii (uszkodzenie nerwów, mitochondriów, infiltracji tkanki mięśniowej komórkami immunokompetentnymi, tkanką tłuszczową i in.)
- i funkcjonowaniu (pacjenci 5 lat po hospitalizacji w stanie krytycznym, w 6-minutowym teście marszu uzyskują jedynie 76% dystansu uzyskiwanego w grupie osób zdrowych (11))
- oraz wpływ tych zmian na inne układy (komunikacja tkanki mięśniowej z innymi układami za pomocą miokin (12)).
W tym kontekście osłabienie po krótkotrwałych hospitalizacjach stanowi początek pewnego kontinuum zmian związanych z utratą tkanki mięśniowej i stanem zapalnym a osłabienie związane z rozległym urazem czy chorobą krytyczną jego koniec (ryc. 2).
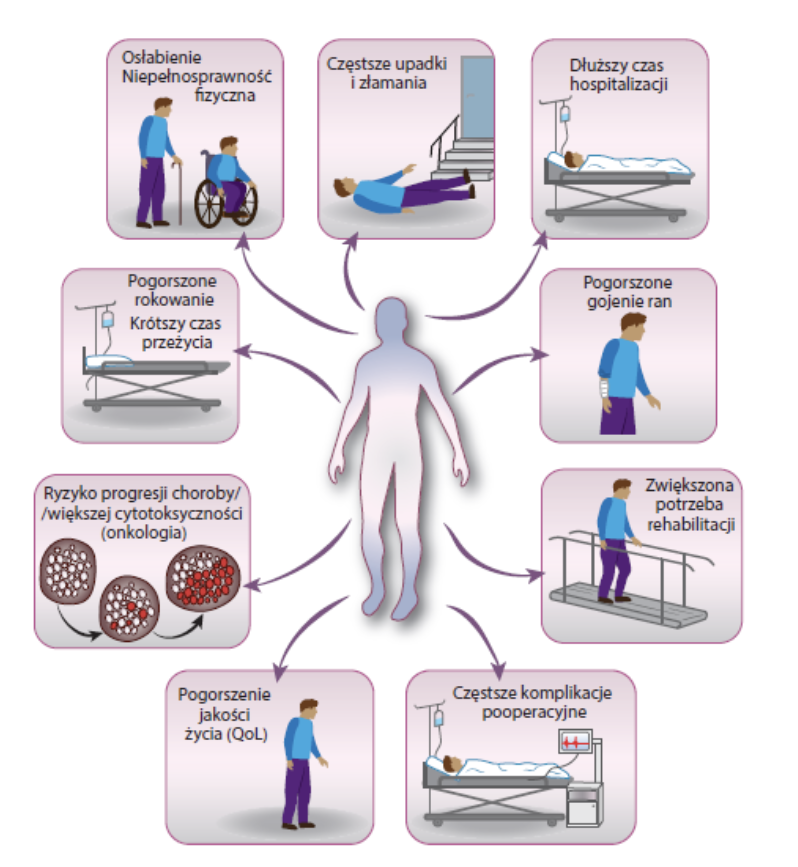
Z jakiego powodu utrata tkanki mięśniowej zwiększa ryzyko zachorowalności i śmiertelności na każdym z oddziałów (all cause mortality)?
Mięśnie są z jednej strony funkcjonalnym „magazynem” aminokwasów, po które organizm sięga w sytuacji urazu lub choroby, w celu syntezy białek ostrej faz, aktywacji i proliferacji komórek układu odporności, odbudowy uszkodzenia, syntezy glukozy w procesie glukoneogenezy. Tkanka mięśniowa to jednak znacznie więcej. Jest m.in. największym organem wpływającym na kontrolę glikemii. Jej utrata, po tygodniowym bezruchu związana jest ze zmniejszoną o 30% wrażliwością na insulinę. U pacjentów po rozległych oparzeniach, z utratą tkanki mięśniowej, wzrost stężenia glukozy i insuliny obserwowany jest do 3 lat po urazie (12).
Dodatkowo pełni funkcję organu endokrynnego uwalniając ponad 650 miokin, z czego dotychczas zidentyfikowano działanie jedynie dla 5% z nich. Wpływają one na funkcjonowanie innych układów np. nerwowego (iryzyna, katepsyna B), immunologicznego (np. PGC-1α) czy hormonalnego.
Wykazano, że sarkopenia, czyli niska masa tkanki mięśniowej i pogorszona jej jakość i wydolność, jest związana z ponad dwukrotnie wyższą śmiertelnością u osób dorosłych niehospitalizowanych (13), ale także z częstszym występowaniem powikłań pooperacyjnych, wydłużeniem czasu pobytu w szpitalu i zwiększeniem śmiertelności pacjentów hospitalizowanych (14). Związane jest to ze złożoną rolą, jaką pełni tkanka mięśniowa (ryc. 3).
Wraz z wiekiem tracimy zarówno masę, jak i siłę tkanki mięśniowej oraz jej jakość i jest to tzw. sarkopenia pierwotna. Proces ten ulega przyspieszeniu zarówno przez chorobę podstawową (sarkopenia wtórna), jak i hospitalizacje, nawet krótkotrwałe, co określane jest mianem katabolicznych kryzysów (16).
Nieadekwatna podaż białka przyczyną katabolizmu tkanki mięśniowej
Katabolizm tkanki mięśniowej pojawiający się w odpowiedzi na uraz lub chorobę podstawową nasilany jest również przez nieadekwatną podaż białka.
Niedobór białka prowadzi także do szeregu niekorzystnych zmian w wielu narządach i układach np. w układzie odporności, następuje m.in. zmniejszenie aktywności fagocytarnej granulocytów i makrofagów, zmniejszenie odpowiedzi typu komórkowego prowadząc do wzrostu powikłań infekcyjnych (16; 17).
W Polsce niestety tylko 20% pacjentów hospitalizowanych otrzymuje dietę z odpowiednią ilością białka (18). Realizacja zapotrzebowania na białko w wysokości 1.2 – 1.5 g/kg m.c. oraz zapotrzebowania energetycznego (wyliczonego na podstawie wzorów) prowadzi do zmniejszenia śmiertelności o 2.7% (19).
Tymczasem dieta szpitalna:
- jest często nieokreślona pod względem zawartości białka i energii,
- istnieje mały wybór posiłków,
- pacjenci nawet starsi, niesamodzielni pozostawieni są sami z posiłkiem (bez wsparcia)
- dodatkowo wiele badań diagnostycznych wykonujemy na czczo, co często powoduje ominięcie spożycia posiłków
- często zalecane jest głodzenie w okresie okołooperacyjnym, mimo że tego typu postępowanie uznane jest za szkodliwe, niezalecane i niezgodne z protokołem ERAS (20).
W kontekście starzejącej się populacji warto zaznaczyć, że u osób starszych występuje zmniejszona synteza tkanki mięśniowej (oporność anaboliczna). Wynika ona z wielu czynników m.in.:
- zaburzonej sygnalizacji wewnątrzkomórkowej,
- upośledzonego krążenia składników odżywczych wraz z krwią,
- obecności chronicznego stanu zapalnego,
- zmniejszonej aktywności fizycznej.
Zatem by uzyskać wzrost syntezy białek mięśni osoby starsze powinny spożywać prawie 2-krotnie więcej białka na posiłek w porównaniu do osób młodych dorosłych (0.4 g/kg m.c. na posiłek u osób starszych vs 0.24g białka/kg m.c./posiłek osoby młode dorosłe) (21).
Przy czym nawet w środowisku domowym pacjenci starsi nie spełniają zapotrzebowania na białko: jedynie 53% na poziomie 1g/kg mc a zaledwie 29% na poziomie 1,2 g/kg mc (22).
W grupie pacjentów, u których podczas hospitalizacji i rekonwalescencji tradycyjna dieta nie wystarczy do pokrycia zapotrzebowania na białko, zgodnie z rekomendacjami ESPEN dla pacjentów chirurgicznych zalecane jest zastosowanie doustnych preparatów odżywczych – ONS (20).
Brak aktywności fizycznej – unieruchomienie (bedrest)
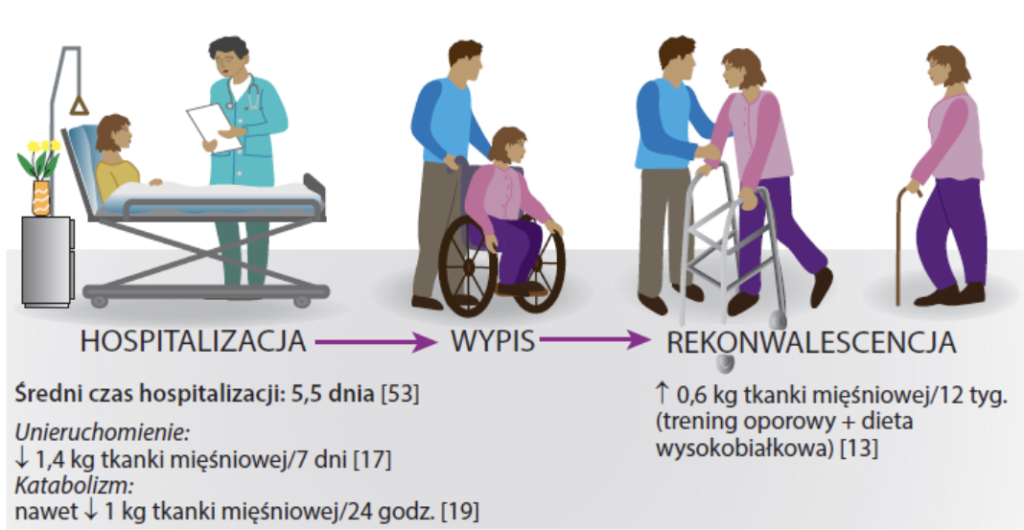
Do najsilniejszych sygnałów anabolicznych, oprócz odpowiedniej podaży białka, należy aktywność fizyczna. Tymczasem pacjenci przebywający w szpitalu zdecydowaną większość czasu spędzają w bezruchu. Szacuje się, że czas spędzony w ruchu to średnio zaledwie 5,5 minuty w ciągu doby przez (2; 4).
Brak ruchu, co niezwykle istotne, zmniejsza o połowę wrażliwość tkanki mięśniowej na sygnał anaboliczny, jakim jest spożycie białka (23). Zatem podaż białka oraz aktywność fizyczna wykazują działanie synergistyczne w kontekście stymulacji syntezy białek mięśni.
Liczne badania wskazują, że utrata tkanki mięśniowej, nawet u osób zdrowych, bez towarzyszącego stanu zapalnego czy urazu następuje niezwykle dynamicznie (16) (23) (24). Unieruchomienie trwające jedynie 5-7 dni powoduje utratę 1.4 kg masy mięśniowej (16). Odbudowa utraconej masy i siły mięśniowej trwa natomiast o wiele dłużej (ryc. 5).
Zaburzenia cyklu okołodobowego a rozwój syndromu poszpitalnego
Ile powinniśmy spać? 7.5 – 9h (5 cykli po 90 min).
Zaburzenia snu, nawet krótkotrwałe lub zmiana jego architektury prowadzi do zmian w licznych układach w tym nerwowym (pogorszenie funkcji poznawczych – zaburzona konsolidacja pamięci, nastrój dysforyczny), hormonalnym (hiperkortyzolemia, hiperinsulinemia), immunologicznym (zmniejszona cytotoksyczność komórek NK – długość snu skorelowana jest ze wzrostem zachorowalności na raka piersi, prostaty, odbytu, macicy). Po jednej nocy zaburzonego snu nasila się katabolizm tkanki mięśniowej i zmniejsza się jej synteza, wzrasta stężenie kortyzolu a to będzie prowadzić do immunosupresji i insulinooporności (25; 26; 27). Dodatkowo dochodzi do zmniejszonej proliferacji i dojrzewania fibroblastów, co będzie skutkowało gorszym gojeniem ran. Po 4 nocach zaburzonego snu wzrasta stan zapalny (CRP, TNFα, IL-6) (27).
Deprywacja snu prowadzi do zwiększonego ryzyka zgonu z jakiekolwiek przyczyny!
Zaburzenie długości i architektury snu prowadzić może do:
- nasilenia katabolizmu tkanki mięśniowej,
- pogorszenia gojenia ran,
- wzrostu ciśnienia krwi i tętna (stała aktywacja osi podwzgórze – przysadka – kora nadnerczy) prowadzący do zwiększonego ryzyka incydentów sercowo-naczyniowych,
- wzrasta wrażliwość na ból,
- pogorszenia funkcji poznawczych,
- zaburzeń nastroju (nastrój dysforyczny).
Pacjenci zgłaszają zarówno krótszy czas trwania, jak i gorszą jakość snu podczas hospitalizacji. U osób hospitalizowanych obserwowane jest skrócenie zarówno całkowitego czasu snu (średnio o 83 min), jak i czasu fazy REM (fazy związanej z konsolidacją pamięci, poprawą funkcji poznawczych), czasu snu głębokiego N3, NREM (fazy związanej z obecnością fal delta, charakteryzujących się najefektywniejszym funkcjonowaniem układu glimfatycznego) oraz wydłużenie snu płytkiego (25). W związku z tym u pacjentów hospitalizowanych obserwować można zwiększoną częstość występowania nastroju dysforycznego, zaburzenia poznawcze, zmniejszoną sprawność fizyczną, wzrost tętna i ciśnienia krwi, zaburzenia żołądkowo-jelitowe (28).
W jakim stopniu stres związany z hospitalizacją jest związany z rozwojem zespołu poszpitalnego?
Niepokój związany z rozpoczęciem hospitalizacji dotyczy większości pacjentów, ponieważ ta związana jest z:
- oczekiwaniem na przyjęcie do szpitala, zabieg operacyjny, badania, wyniki, rozmowę z lekarzem, wizytę rodziny,
- koniecznością zmiany swoich codziennych przyzwyczajeń, zorganizowanie życia rodzinnego „bez mojej obecności”,
- niepewnością dotyczącą przyszłości.
Pacjenci nagle znajdują się w środowisku, które może się stać nie tylko stresujące, ale nawet toksyczne (2; 4).
W efekcie reakcji na stres następuje zwiększona synteza i uwalnianie hormonów katabolicznych (tj, adrenalina, noradrenalina, glukagon, kortyzol), które stymulują endogenną produkcję glukozy oraz zmniejszają zużycie glukozy w tkankach insulinowrażliwych. W związku z tym reakcja na stres nasilać będzie niekorzystne działanie unieruchomienia oraz braku podaży adekwatnej ilości białka na tkankę mięśniową.
Stres nie tylko będzie powodować aktywację osi HPA (wzrost ciśnienia krwi, tętna) ale także będzie nasilać stan zapalny w obrębie jelit prowadząc do braku dojrzewania neuronów unerwiających przewód pokarmowy (na skutek zmniejszonego uwalniania acetylocholiny), co w konsekwencji będzie powodować spowolnienie motoryki przewodu pokarmowego (29).
Kolejnym istotnym obszarem, wpływającym na funkcjonowanie pacjenta po hospitalizacji jest jej wpływ, wraz ze wszelkimi interwencjami (antybiotykoterapia, badania diagnostyczne, zabiegi chirurgiczne i wiele innych) oraz zmianą środowiska, w którym pacjent przebywa na mikrobiotę jelitową. Podobnie jak tkanka mięśniowa, mikrobiota w sposób dwukierunkowy komunikuje się z licznymi układami organizmu wpływając na np. odpowiedź zapalną – funkcjonowanie układu immunologicznego, układu nerwowego czy hormonalnego i in.
Co możemy zrobić, by zmniejszyć ryzyko wystąpienia syndromu poszpitalnego? Szczególna rola lekarza rodzinnego
Celując w zmniejszenie katabolicznej odpowiedzi na różne czynniki musimy przede wszystkim zapewnić odpowiednią podaż białka i aktywność fizyczną (ryc 4). Są to konieczne dwa elementy, niezbędne do wdrożenia u każdego pacjenta po hospitalizacji w celu uniknięcia syndromu poszpitalnego a zatem powikłań i rehospitalizacji.
Należy zwrócić uwagę, że w przypadku osób starszych stymulacja anaboliczna wymaga podaży prawie 2-krotnie większej ilości białka na posiłek niż w przypadku osób młodych (21) przy czym spożycie białka nie jest wystarczające nie tylko u większości pacjentów hospitalizowanych(18), ale także w środowisku domowym (22).
W związku z tym w grupie pacjentów, u których podczas hospitalizacji i rekonwalescencji tradycyjna dieta nie wystarczy do pokrycia zapotrzebowania na białko, zgodnie z rekomendacjami ESPEN, zalecane jest zastosowanie doustnych preparatów odżywczych – ONS dla bardzo dużej grupy pacjentów: zwłaszcza pacjentów z wielochorobowością (30), starszych (31), chirurgicznych (20), neurologicznych (32), onkologicznych (33).
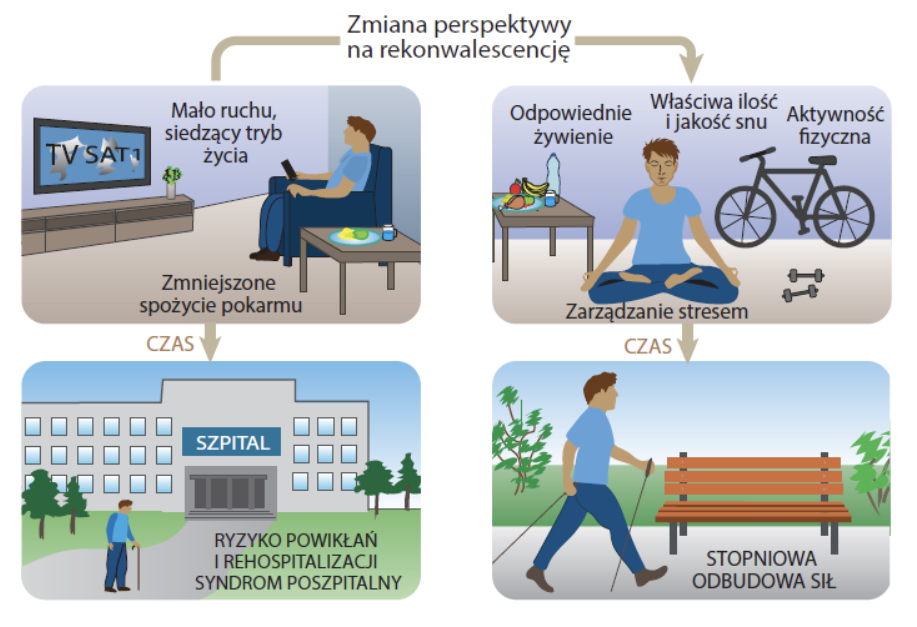
Aktywność fizyczna jest niezbędnym elementem powrotu do zdrowia po każdej hospitalizacji. Jest nie tylko niezbędna w stymulacji odpowiedzi anabolicznej ale także zwięsza wrażliwość tkanki mięśniowej na wzrost stężenia aminokwsów i insuliny a efekt ten może utrzymywać się do 24h (34). Aktywność fizyczna powoduje zmniejsznie ryzyka przedwczesnej śmierci o 20-30%; zmniejszenie ryzyka wystąpienia depresji o 5%; zmniejszenie ryzyka wystąpienia incydentów sercowo-naczyniowych o 7-8% (35).
Jakie ilości ruchu możemy rekomendować? Oczywiście każdą tego typu rekomendację należy dostosować do możliwości i stanu pacjenta a najlepiej zasięgnąć konsultacji fizjoterapeuty. Możemy jednak w pewnym stopniu kierować się rekomendacjami WHO dla osób powyżej 65 r.ż., osób z chorobami przewlekłymi czy niepełnosprawnością, według których minimalny czas aktywności fizycznej to tygodniowo 150-300 min aktywności aerobowej o umiarkowanej intensywności tygodniowo w połączeniu z treningiem wzmacniającym mieśnie (oporowym) 2-3 razy w tygodniu (35). Zgodnie z wytycznymi WHO: każda aktywność fizyczna jest lepsza niż żadna, a im jej jest więcej, tym lepiej. Wzmacnianie mięśni przyniesie korzyść każdej osobie zdrowej, a także, a może przede wszystkim, pacjentom.
Jak długo po hospitalizacji należałoby rekomendować tego typu interwencje?
Odbudowa tkanki mięśniowej to proces. Resynteza 1.4 kg tkanki mięśniowej u osób starszych, przy odpowiedniej podaży białka i zachowanej aktywności fizycznej będzie trwać nawet 6 miesięcy (16; 36; 37).
Nie można zapomnieć o pozostałych elementach wpływających na rozwój syndromu poszpitalnego tj. dbałość o wystarczającą ilość snu oraz niwelowanie wpływu stresu (Ryc. 6).
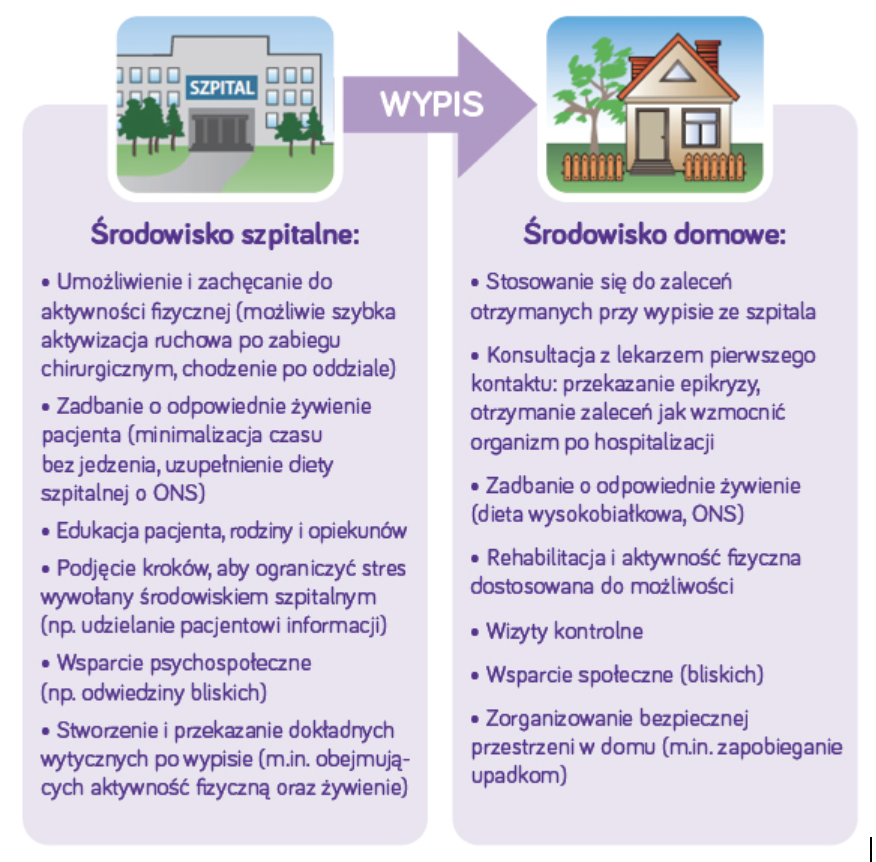
PODSUMOWANIE – co zrobić, aby wypis ze szpitala i powrót do domu był początkiem zdrowienia?
Syndrom poszpitalny to okres osłabienia trwający długo po zakończeniu hospitalizacji. Na jego rozwój ma wpływ zarówno sama choroba podstawowa, jak i nieadekwatna podaż białka i energii podczas pobytu pacjenta w szpitalu oraz unieruchomienie, odpowiedź organizmu na stres i zaburzenie cyklu okołodobowego. Osłabienie występujące po hospitalizacji to niezależny czynnik ryzyka rehospitalizacji i powikłań! Jakość życia w 30 dniu po hospitalizacji może stanowić dobry wskaźnik ponownej hospitalizacji w przeciągu roku (38).
W celu uniknięcia konsekwencji związanych z syndromem poszpitalnym należałoby rekomendować zarówno odpowiednią podaż białka jak i aktywność fizyczną dostosowaną do możliwości pacjenta.
Odbudowa tkanki mięśniowej przy odpowiedniej podaży białka i zachowanej aktywności fizycznej będzie trwać wiele miesięcy, nawet lat. Musimy jednak zwrócić uwagę, że większość pacjentów nie uzyskuje odpowiedniej ilości białka podczas hospitalizacji jak i w trakcie rekonwalescencji. W związku z tym zasadne jest udzielanie rekomendacji spożywania doustnych preparatów odżywczych – ONS na cały okres odbudowy sił i powrotu do zdrowia po pobycie w szpitalu.

Bibliografia
1. Vanhorebeek I et al. ICU-acquired weakness. . Intensive Care Med. . 2020, Apr;46(4):637-653. doi: 10.1007/s00134-020-05944-4.
2. Di Girolamo et al. The Aging Muscle in Experimental Bed Rest: A Systematic Review and Meta-Analysis. . Front Nutr. 2021, Aug 4;8:633987. doi: 10.3389/fnut.2021.633987.
3. Krumholz, HM. Post-hospital syndrome–an acquired, transient condition of generalized risk. The New England Journal of Medicine. 2013, Jan 10;368(2):100-2. doi: 10.1056/NEJMp1212324.
4. Caraballo C et al. Post Hospital Syndrome: Is the Stress of Hospitalization Causing Harm? . Rev Esp Cardiol (Engl Ed). 2019 , Nov;72(11):896-898. English, Spanish. doi: 10.1016/j.rec.2019.04.010.
5. Puthucheary ZA et al. Acute skeletal muscle wasting in critical illness. JAMA. 2013, Oct 16;310(15):1591-600. doi: 10.1001/jama.2013.278481.
6. Yu J et al. Risk factors for postoperative fatigue after gastrointestinal surgery. J Surg Res. 2015 , Mar;194(1):114-9. doi: 10.1016/j.jss.2014.09.041.
7. Waterer, G. Recovery from community acquired pneumonia: the view from the top of the iceberg. Eur Respir J. 2017, Jun 15;49(6):1700571. doi: 10.1183/13993003.00571-2017.
8. Farhan H et al. Acquired Muscle Weakness in the Surgical Intensive Care Unit: Nosology, Epidemiology, Diagnosis, and Prevention. Anesthesiology. 2016, Jan;124(1):207-34. doi: 10.1097/ALN.0000000000000874.
9. Zisberg A et al. Low mobility during hospitalization and functional decline in older adults. J Am Geriatr Soc. 2011, Feb;59(2):266-73. doi: 10.1111/j.1532-5415.2010.03276.x.
10. Mesquita, Evandro Tinoco, et al. Post-Hospital syndrome; a new challenge in cardiovascular practice. Arquivos brasileiros de cardiologia. 105, 2015, Årg. 540-544.
11. Herridge SM et al. Functional Disability 5 Years after Acute Respiratory Distress Syndrome. N Eng J Med. 2011, Apr 7;364(14):1293-304. doi: 10.1056/NEJMoa1011802, s. 1293-304.
12. Severinsen MCK et al. Muscle-Organ Crosstalk: The Emerging Roles of Myokines. Endocr Rev. 2021, 2020;41(4):594-609. doi:10.1210/endrev/bnaa016.
13. Xu J et al. Sarcopenia Is Associated with Mortality in Adults: A Systematic Review and Meta-Analysis. Gerontology. 2022, 68(4):361-376. doi: 10.1159/000517099.
14. Bayraktar E et al. Relationship between Sarcopenia and Mortality in Elderly Inpatients. . Eurasian J Med. 2020 , Feb;52(1):29-33. doi: 10.5152/eurasianjmed.2020.19214.
15. Prado, CM et al. Advances in muscle health and nutrition: A toolkit for healthcare professionals. 2022, Årg. 41, 2244-2263.
16. English KL, Paddon-Jones D. Protecting muscle mass and function in older adults during bed rest. . Curr Opin Clin Nutr Metab Care. . 2010 , Jan;13(1):34-9. doi: 10.1097/MCO.0b013e328333aa66.
17. Sobotka L et al. Podstawy żywienia klinicznego. Edycja Czwarta. Wydanie Polskie. Prague : Krakowskie Wydawnictwo Scientifica Sp. z o.o., 2013.
18. Kłęk S. Ocena terapii żywieniowej w polskich szpitalach. POLSPEN. 2018, http://nadziejadlazdrowia.pl/wp-content/uploads/2019/06/Raport_Ocena_terapii_%C5%BCywieniowej_w_polskich_szpitalach_2018.pdf.
19. Schuetz P et al. Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet. .
2019 , Jun 8;393(10188):2312-2321. doi: 10.1016/S0140-6736(18)32776-4.
20. Weimann, Arved et al. ESPEN practical guideline: Clinical nutrition in surgery. 2021, Årg. 40.7, 4745-4761.
21. Moore DR et al. Protein ingestion to stimulate myofibrillar protein synthesis requires greater relative protein intakes in healthy older versus younger men. J Gerontol A Biol Sci Med Sci. . 2015 , Jan;70(1):57-62. doi: 10.1093/gerona/glu103.
22. Hengeveld, Linda M. et al. Prevalence of protein intake below recommended in community‐dwelling older adults: a meta‐analysis across cohorts from the PROMISS consortium. 2020, Årg. 11.5, 1212-1222.
23. Wall B.T. et al. Short-term muscle disuse lowers myofibrillar protein synthesis ratesand induces anabolic resistance to protein ingestion. Am J Physiol Endocrinol Metab. 2016, 310: E137–E147, 2016; doi:10.1152/ajpendo.00227.2015.
24. Phillips SM et al. Optimizing Adult Protein Intake During Catabolic Health Conditions. . Adv Nutr. . 2020 , Jul 1;11(4):S1058-S1069. doi: 10.1093/advances/nmaa047.
25. Stewart NH et al. Sleep in Hospitalized Older Adults. Sleep Med Clin. Mar;13(1):127-135, 2018, doi: 10.1016/j.jsmc.2017.09.012.
26. Morrison M et al. Sleep, circadian biology and skeletal muscle interactions: Implications for metabolic health. Sleep Med Rev. . Dec;66:101700, 2022 , doi: 10.1016/j.smrv.2022.101700.
27. Garbarino S et al. Garbarino S, Lanteri P, Bragazzi NL, MagnRole of sleep deprivation in immune-related disease risk and outcomes. Commun Biol. . Nov 18;4(1):1304, 2021 , doi: 10.1038/s42003-021-02825-4.
28. Wesselius, HM. Quality and Quantity of Sleep and Factors Associated With Sleep Disturbance in Hospitalized Patients. JAMA Intern Med. 2018, Sep 1;178(9):1201-1208. doi: 10.1001/jamainternmed.2018.2669.
29. Schneider KM et al. The enteric nervous system relays psychological stress to intestinal inflammation. Cell. 2023, DOI: https://doi.org/10.1016/j.cell.2023.05.029.
30. Gomes F et al. ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clinical Nutrition. 2017, 0261-5614.
31. Volkert D et al. ESPEN guideline on clinical nutrition and hydration in geriatrics. Clinical Nutrition. 2018, 0261-5614.
32. Burgos R et al. ESPEN guideline clinical nutrition in neurology. Clin Nutr. Feb;37(1):354-396, 2018, doi: 10.1016/j.clnu.2017.09.003.
33. Muscaritoli M et al. ESPEN practical guideline: Clinical Nutrition in cancer. Clinical Nutrition. 2021.
34. Gorissen S.H.M. et al. The muscle protein synthetic response to food ingestion. Meat Science. 2015, 0309-1740; http://dx.doi.org/10.1016/j.meatsci.2015.05.009.
35. WHO. WHO guidelines on physical activity and sedentary behaviour. Geneva: World Health Organization. 2020, Licence: CC BY-NC-SA 3.0 IGO.
36. Wall BT, van Loon LJ et al. Short-term muscle disuse lowers myofibrillar protein synthesis rates and induces anabolic resistance to protein ingestion. Am J Physiol Endocrinol Metab. 2016, Jan 15;310(2):E137-47. doi: 10.1152/ajpendo.00227.2015.
37. Robinson SM et al. Does nutrition play a role in the prevention and management of sarcopenia? Clin Nutr. Aug;37(4):1121-1132, 2018, doi: 10.1016/j.clnu.2017.08.016.
38. Struja T et al. Quality of life after hospitalization predicts one-year readmission risk in a large Swiss cohort of medical in-patients. Qual Life Res. 2021;30(7):1863-1871, doi:10.1007/s11136-021-02867-5.
Artykuł sponsorowany przez Nutrica Polska








